癌症的遗传原因比序列变异的原因多,这种附加的复杂性为科学家提供了一个更早处理癌症的机遇
是什么导致细胞发生癌变呢?自1989年癌基因发现以来,盛行的理论是突变的基因推动了这一过程:癌症的倾向是以某种方式写进我们遗传密码里的。这令人沮丧的描写可能会使癌症预测得早一些,但是阻碍了预防癌症的努力。幸运的是,这一情况变得更加复杂。
位于马里兰州巴尔的摩市的约翰·霍普金斯大学的遗传学家伯特·沃格斯坦(Bert Vogelstein)阐明了第一个癌基因以及随后发现的几个癌基因的作用,他是“癌症是一种遗传性疾病”这个理念的发起人之一。最近,在对卵巢癌患者进行切片检查时,他发现超过一半的肿瘤样品在ARID1A基因上都存在变异。然而,ARID1A基因并不直接刺激肿瘤的形成。沃格斯坦说:“我们没有想到的是,这一基因涉及到确定能导致肿瘤的表观遗传的变化。”即ARID1A基因的致癌作用是通过在基因表达水平上刺激变化而发生的,并不在DNA序列中。
沃格斯坦的发现只是冰山一角。癌症基因组计划(Cancer Genome Project),是一个通过国际间的努力来对许多不同类型癌症的基因组进行测序的计划,它也发现“事实上存在数量上多得难以置信的突变影响了表观遗传学和表观遗传调节子”。珍-皮埃尔·伊萨(Jean-Pierre Issa)说,她是位于休斯顿市的MD安德森癌症中心(MD Anderson Cancer Center)的一名表观遗传学家,也是该计划的一名研究人员。沃格斯坦对ARID1A基因的洞察,提示了癌症中存在连接遗传学和表观遗传学的诸多途径。伊萨解释说:“它关闭了这个回路,因为我们发现即使基因损伤也受到表观遗传机制的控制。”
这些发现使科学家意识到,癌症的根本原因比遗传或后天的基因突变更加复杂。约翰·霍普金斯大学的肿瘤学家戴维·西德兰斯基(David Sidransky)说:“我们过去通常以二元术语如基因突变或无突变来思考癌症,但现在再也不是这样了。”研究人员正在发现,表观遗传变化频繁地处于领先地位并能诱导可引起癌症的基因突变。如果这些早期的表观遗传变化能够被检测到和逆转,就可能会预防某些癌症。
超越人类基因组
最有名的表观遗传修饰就是甲基化,即凭借一个甲基基团(CH3)连接到一部分DNA上。基因的甲基化作用能减少或停止基因的表达(见下图:DNA甲基化模式)。甲基化的模式可继承母本或在生命过程中获得。如果遗传密码是生命的硬件,那么表观遗传密码就是决定硬件行为的软件,并且只有这样才能重写。
人类基因组计划(HGP)旨在解码生命的硬件,科学家希望HGP的一个结果就是发现引起疾病的基因突变。但是,像BRCA1/2基因那样的突变以及对癌症风险的高度预测,后来发现都是例外而不是规律。的确,HGP帮助确认了潜在的多数普通疾病都是几百个(如果不是几千个)基因突变,并且因人而异。“甚至HGP草图在2000年完成之前,不利用表观遗传学来理解癌症的遗传学是明显不可能的”,伊萨说。
对癌症表观遗传学的研究开始于20世纪80年代中期约翰·霍普金斯大学癌症生物学家斯蒂芬·贝林(Stephen Baylin)的实验室。他注意到癌细胞含有甲基化增加的DNA区域,并假设如果一个肿瘤抑制基因高度甲基化,那么它的活性将降低或完全停止,这就如同发生了基因突变使得肿瘤发展。贝林分析说,这种表观遗传变化将产生像基因突变一样的结果。
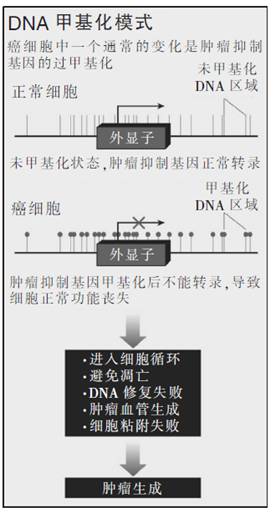
1994年获得了确凿的证据。贝林和他的同事、肿瘤学家詹姆斯·赫尔曼(James Herman)研究了肾细胞癌(RCC),这是成人中最普通的一种肾癌。大约60%的RCC是由VHL(von-Hippel Lindau)肿瘤抑制基因的遗传变异引起的,这阻碍了基因表达肿瘤抑制蛋白的能力。贝林和赫尔曼表示,剩余的20%的患者具有非遗传性形式的RCC,他们在VHL基因上不具有突变。他们的基因不是因变异而是由于高度甲基化作用而沉默。
第二年,贝林、赫尔曼和西德兰斯基实验室共同表明,人类癌症一般出现于一个特殊的肿瘤抑制基因p16被高度甲基化的时候。此外,在包括RCC在内的许多癌症中,表观遗传和基因突变通常是联合作用的:肿瘤抑制基因中两个拷贝中的一个是受基因突变灭活的,而另一个是高度甲基化的。这一发现“使我们相信表观遗传异常在癌症中起到重要的推动作用,而且我们和其他研究人员从那时起一直追求这种可能性。”贝林说。
从纯粹的基因模型转化为表观遗传模型的步骤对于预防策略是至关重要的。大量的基因治疗试验显示,通过重新激活休眠的变异基因或利用非突变基因进行取代来治疗遗传性疾病是非常困难的。穆克什·维尔马(Mukesh Verma)说:“表观遗传变化是可逆的,因此在遗传学方面具有优势。”他是位于马里兰州贝塞斯达市的美国国立癌症研究所的癌症控制与人口科学部的一名表观遗传学家。此外,癌症中的表观遗传变化发生于基因突变之前。“如果能阻止这些肿瘤抑制基因的甲基化,那么就可能会得到一个有价值的预防策略。”贝林说。
环境的环节
表观遗传学也提供了与癌基因变化相关的环境因素的线索。甲基化方面的变化能在未患癌症个体的血液中检测到,但这些个体吸烟并有高脂肪饮食,显示这些变化先于基因突变。最近,美国布朗大学(位于罗德岛州普罗维登斯市)的分子表观遗传学家卡尔·凯尔西(Karl Kelsey)揭示了介于乳腺癌中的表观遗传模式、肿瘤大小、饮酒量和叶酸摄入量之间的独立关系。
在环境和遗传学的联系点中,首选的是慢性炎症,它的发展早于多种类型的癌前期病变和特定的癌症本身,包括食道癌、肝癌和结肠癌。炎症与DNA甲基化的增加有关。伊萨将慢性炎症称为“一个真正的表观遗传现象”。
长期的炎症可能是幽门螺旋杆菌或丙型肝炎病毒感染的结果,或者来自一些自身免疫性疾病,例如溃疡性结肠炎。患有溃疡性结肠炎的病人通常在低龄阶段发展为结肠癌,例如比起平均年龄为60或70岁,50岁即为低龄阶段。“所有发生在结肠癌中的表观遗传变化,特别是DNA的高度甲基化或基因沉默都是加速的,并且在发展为真正的癌症之前就在发炎组织中发现了”,贝林说。
世界上一半的人口受到引起癌症的幽门螺旋杆菌的感染,然而受胃癌折磨的只是这其中的0.03%。苏格兰阿伯丁大学的胃肠病学家艾玛德·艾尔奥马尔(Emad El-Omar)说:“在机体内肯定有某些物质,这些物质使机体对传染的反应不同。”他正在研究遗传变异能否影响这一反应。
遗传多态性是群体内正常的遗传变异,它们能巧妙地提高或降低每个人特定蛋白质的水平。尽管正常人群中的个体都能产生相同的前炎症性和消炎化学物质(或细胞因子),但是个体的特定水平随着基因构成的差异而变化。艾尔奥马尔猜测,某些多态性可能会对慢性炎症和癌症起决定性作用。
艾尔奥马尔发现,与炎症相关的IL-1B和TNF-α基因(transforming growth factor,TNF)的多态性,决定了循环的IL-1B和TNF-α前炎症反应细胞因子的水平。具有更高水平细胞因子的基因型的人群,在感染幽门螺杆菌后罹患胃癌的风险增加。艾尔奥马尔也在其他癌症中获得了类似的发现。例如在大肠癌中,他发现在癌前病变周围存在一个炎症环境。在这一区域,他发现九个不同表达的基因与炎症相关,包括那些负责IL-8和细胞因子CXCL家族的基因。
其他研究人员正在做着相似的联系研究。例如,前炎症反应中前列腺素过氧化物合成酶和TGF-β都明显与结肠癌患病风险的增加有关。尽管将炎症与表观遗传学和癌症相联系的证据非常多,但是这一联系中的潜在机制和这些多态性的筛选价值尚不清楚。
逆转潜能
能够改变表观遗传途径的药物和膳食性物质最近得到测试。例如,贝林和同事在RCC的研究中能够利用药物5-氮胞苷逆转VHL的高度甲基化。利用去甲基化药物作为辅助治疗来预防癌症再次发生的实验正在进行,如果成功,预防实验就是下一个合乎逻辑的步骤。伊萨说:“我们需要那些利用当前药物进行治疗5年或10年的生存数据,以确保在我们给适度健康人群服用药物来预防癌症之前,不会产生副效应。”他预见到了第一波预防药物的不同来源。“我将期望发现更多的能够预防癌症的‘温和的’方法,确保它们都是天然物质,具有良好的安全记录的药物,甚至是维生素或饮食。”
表观遗传学变化也可作为生物标记物来发挥潜在效用。能理解某些基因的甲基化模式,这给了科学家一个警告,在他们对待处于罹患癌症边缘的人们时。
在癌症发展过程中,表观基因组的重要性正在慢慢被领会。“遗传学家更加清醒地意识到表观遗传学在癌症发展中的重要性”,贝林评论说。癌症预防的未来在于:在把握不可逆突变之前能够获得可逆的表观遗传学变化。
资料来源 Nature
责任编辑 彦 隐