如果能预知罹患癌症的概率,将会极大地改善健康风险管理策略和临床试验过程
在你第一次点燃香烟之前,是否清楚地知道这将会有多大的概率导致癌症呢?尽管吸烟是导致肺癌的主要原因,但却只有10%~20%的吸烟者罹患此症。数十年来,这背后的原因让研究人员一直难得其解。
从全世界范围来看,肺癌的发生率高居所有癌症的首位,因此也是癌症防控的优先领域。为了取得最好的癌症预防效果,有针对性的辨别癌症高发人群就显得尤为重要。而这就是生物标记的“用武之地”。通过生物标记,癌症高发群体不仅可以接受改变生活方式等咨询建议,还可以采取综合性化学预防措施。甚至在此之前,利用生物标记对人群进行筛选,从而使临床试验取得更好的效果。事实上,从各类生物标记的功能来看,并不存在“知癌症于未然”和“识癌症于初患”的明显区别。
癌症的发生发展往往要经历几年的时间,而相关的研究旨在发现和证实存在于血液、唾液、尿和组织样本中能预知癌症发生的细微成分变化:在致癌的信号通路激活之前,就可能发现DNA修复机制失调、基因表达改变或检测到肿瘤初期的免疫系统变化。
难以避免的是该项研究同样也存在很多争议。无数次的失败结果显示,有些看上去很有应用前景的生物标记无法通过严格的测试。要达到临床应用的水平,生物标记必须具备灵敏性――即检测疾病的可能性――至少要达到90%;另一项关键指标是特异性――即显示疾病的阳性信号的正确率――也要达到90%或以上。尽管目前还没有达到上述两种标准的肺癌生物标记,但至少有几种颇具前景的候选者值得一提。
改变表达
阿拉姆·斯佩拉(Avrum Spira)是波士顿大学的一名胸腔内科医师,他通过支气管镜检技术从健康的吸烟者和非吸烟者中获取了支气管上皮细胞,并进行了基因表达分析,对上千种基因进行比较。他发现在吸烟者的细胞株中,存在与炎症和细胞增殖有关的基因改变,即使这些细胞在镜检中显示正常。通过将实验结果与疑似肺癌的吸烟者进行比较,斯佩拉的研究团队鉴别出一个由80种基因组成的信号,该信号对于早期肺癌的灵敏性达到了90%。斯佩拉把它称为“传说中的在矿井中用来探测瓦斯的金丝雀”。
然而,支气管镜检具有一定程度的创伤性,于是斯佩拉设法在呼吸道的其他位置寻找可供研究的组织。最近他在鼻腔和口腔上皮中发现了与支气管上皮类似的异常基因表达现象――仅用棉签就可以获取这些细胞,从而为设计大规模人群筛选的工具提供了可能。
斯佩拉与来自犹他大学的基因学家安德鲁·比尔德(Andrea Bild)一起,通过研究隐藏在这些癌前病变背后的机制,发现了与癌症发生密切相关的P13K信号通路。通过将健康吸烟者和轻度或中度异常的吸烟者细胞中P13K的活动水平进行比较,他们又发现该信号通路可能在肿瘤发生前就被激活。这样,P13K就成为了一种主要的候选生物标记。
P13K信号通路同时也可用于癌症的化学预防措施。早期实验显示,某种化合物可以降低P13K信号通路的活性,随之使高风险吸烟者呼吸道细胞的异常程度得到减轻。
DNA损伤
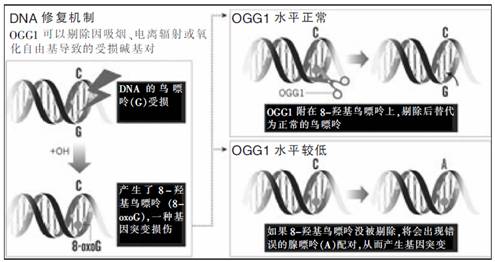
在日常生活中,DNA经常会受到损伤。如果没有得到修复,将导致基因变异引发的细胞异常甚至诱发癌症。通常有某种机制可以阻止上述问题发生,如8-羟基鸟嘌呤DNA糖苷酶(OGG1)可以通过删除受损伤的碱基对起到修复DNA的功能。来自以色列魏茨曼科学研究院的生物化学家兹威·利维尼(Zvi Livneh)和塔玛·帕兹·伊莱泽(Tamar Paz-Elizur)发现,OGG1同时也能用来预测罹患肺癌的风险。
通过测量血液样本中的OGG1浓度,利维尼和伊莱泽发现40%的肺癌患者OGG1水平过低;而正常人群中只有4%的人OGG1水平较低。OGG1水平较低的吸烟者与OGG1水平正常的吸烟者相比,前者的肺癌发生率高于后者5~10倍;与OGG1水平正常的非吸烟者相比,该比例高达120倍!这种血液测试还可以扩大应用于其他癌症。例如,OGG1水平较低的吸烟者与OGG1水平正常的非吸烟者相比,前者罹患颈部癌症的风险比后者大70倍。
OGG1只是数目不详的DNA修复酶之一;其中任何一种酶类的水平降低都可能与癌症发生相关。利维尼和伊莱泽目前正在对另外两种DNA修复酶类――AAG和APE1――进行研究,目的是研究致癌的多种风险因素。
任何单项测试(即使包括多种生物标记)都不足以准确测量癌症发生的风险。据利维尼称,他们“正在探索使用一种双阶段的肺癌预防工具”。第一阶段包括利维尼和伊莱泽的DNA修复生物标记和其他团队发现的5种生物标记。这些标记测量的对象是:基因表达的变化、DAP激酶水平(一种与细胞程序性凋亡有关的酶类、P53突变抗体)、细胞肿瘤抑制系统受损时的信号、炎症标记以及癌症相关基因的变化情况。利维尼认为:“这些生物标记的组合与单独一种标记相比,能够产生更好的风险评估效果。”确定为癌症高风险的人群将进一步通过螺旋CT检测。利维尼说:“对于高风险人群而言,螺旋CT的早期检测可以达到既实用又救命的目的。”
在癌症的初发阶段,机体通常能够识别异常的细胞改变,并给予应对以产生自身抗体。然而,这种应对毕竟是有限的,当癌症发展到后期,免疫系统的功能将会降低,不再识别和攻击癌症细胞,自身抗体因此也成为了癌症早期主要的候选生物标记。
仍不乐观
西雅图的弗雷德·哈钦森癌症研究中心的萨米尔·哈纳什(Samir Hanash),通过对肺癌的癌前病变患者的自身抗体形成情况进行研究,发现了三种重要的抗原分子――膜联蛋白1(annexin-1)、14-3-3Theta和LAMR-1――被机体免疫系统当作异物。总体来说,这些生物标记的特异性极高,但灵敏性只有60%左右。哈纳什面临的挑战是如何发现能够提高这三种分子组合效果的抗原。
上述数据也可以通过寻找癌症更早期的信号得以优化。通过“妇女健康行动”和“医师健康研究计划”,哈纳什可以获取到持续保存下来的、被诊断为肺癌之前长达8年的患者血液样本。此外,他还在寻找早期吸烟者和非吸烟者的肺癌生物标记。哈纳什说:“结果显示,我们从吸烟者中发现的大部分血液标记对非吸烟者来说也同样有用。”
尽管在过去15年里,我们在生物标记方面做了大量投入,但癌症预防生物标记领域的发展看上去仍然不够乐观。其中的主要原因之一,据多伦多大学临床生物化学家埃莱夫塞里奥斯·蒂亚曼提斯(Eleftherios Diamandis)称,是由于研究设计存有缺陷和统计不够精确所致。大多数研究主要集中于癌症治疗方面的生物标记上。事实上,临床应用的大多数生物标记不适合开展大规模人群筛选或早期诊断。
蒂亚曼提斯称,之前的癌症生物标记研究走错了方向,即过多地集中在基因标记方面,而这种标记仅代表了一种“计算机语言”――只有“是”或“否”。他认为,对于代谢或蛋白质水平的生物标记而言,它们代表的是定量的改变,但是这种标记非常脆弱。“它们受样本收集储存方法、各种疾病甚至饮食和用药情况的影响”,他说,“一组看上去非常不错的数据随后就可能再也难以获得,因此不适于在临床方面应用。”
乔治·波斯特(George Poste)是亚利桑那州立大学的复杂适配系统计划的领导者,他也认为,由于各种各样的原因,生物标记研究距离实际应用还有一定距离。他说,部分问题在于,该领域大多数研究计划的规模太小,在研究结果方面也缺少统一的判断标准。比如,样本采集和加工的标准各异、用细胞株而不是患者活体组织进行研究和患者样本数量的不足等,这些都是生物标记研究中有待克服的障碍。
波斯特以美国国立癌症研究所(NCI)的癌症人类生物银行和英国生物银行为例说,(他们)绝大部分的癌症研究经费流向了治疗方面,而不是预防。“关键问题是我们如何在癌症发生早期、癌细胞扩散之前就能够发现它。”这就是研究生物标记的意义所在。“如果我们能在癌症的最早期发现它,未来就有可能阻止它!”
资料来源 Nature
责任编辑 则 鸣
――――――――
本文作者维基·布劳尔(Vicki Brower),纽约的一名自由撰稿人。