
毫无疑问,疫苗是一项最伟大的医学成果,然而,它们究竟能在多大程度上帮助我们预防癌症呢?
癌症就像一个精心伪装的破坏者,有时以不寻常蛋白的形式存在,来逃避检测异常生长的免疫系统的监测。几十年来,科学家尝试着研发克服这个弱点的疫苗(通常注入挂有“被通缉”标志的与肿瘤相关的蛋白质),来帮助免疫细胞识别并杀死癌细胞。
在经过一系列代价昂贵和令人沮丧的失败后,最近,治疗性的癌症疫苗迎来了有史以来的一个大突破。2010年4月,FDA批准了美国首个癌症治疗疫苗Provenge(sipuleucel-T)。虽然没有取得毫无争议的成功,但洛杉矶南加州大学诺里斯(Norris)综合癌症中心的癌症疫苗专家马丁·卡斯特(Martin Kast)说:“一般来说,此种方法可使病人的生命延长4个月,也确实合乎许多化学治疗的标准,但仍然还有很长的路要走。”
问题是,随着癌症的恶化,癌症将导致免疫系统瘫痪,以防止免疫系统进行有力反击。因此,卡斯特及其他研究人员又重新将注意力集中到癌症疫苗上来,在癌症发病之前将其作为预防措施。俄亥俄州克利夫兰临床医学中心的免疫学家文森特·托赫(Vincent Tuohy)说,不要在得脊髓灰质炎后再注射疫苗(而应该在受到病原体感染前注射疫苗)。“我们希望免疫系统和治疗性的疫苗一起,并且英勇地加入消除庞大且成熟的肿瘤组织的队伍,但这是一个难题。如果你想远离一种疾病,你必须提前预防它。”
捕捉癌症
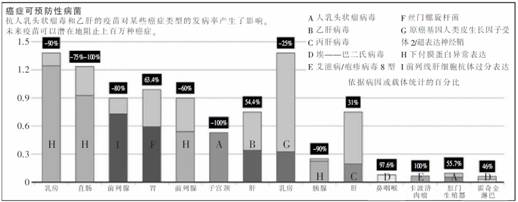
到目前为止,抗癌疫苗的最好范例是防止致癌感染。例如,抗乙肝病毒的疫苗会提供持久的保护,防止肝癌产生,因为大约54%的肝癌是由肝炎病毒引起的。一项在台湾20年的研究表明,接种疫苗将发生肝癌的风险降低大约70%。
抗人乳头状瘤病毒的疫苗(HPV,见图)可以起更大的作用。在全世界范围来说,HPV将导致50多万例的宫颈癌以及6万多例的直肠癌、生殖器癌和咽喉癌。Gardasil(默克公司,2006年批准)和Cervarix(2009年批准)是两个由FAD批准的疫苗,它们都在预防HPV菌株16和18的感染上表现出了显著的效果,HPV菌株16和18可引起大量与HPV有关的癌症。美国国立癌症研究所肿瘤疾病部门的负责人约翰·席勒(John Schiller)说:“我对我们长期的预防措施非常有信心。”他也是这两种疫苗的一个共同发明人。
然而,至少有数十种致癌性的HPV可以抵抗这些疫苗。疫苗的作用范围决定于它的效价,它被不同的靶细胞识别,并将其呈递给免疫系统。Gardasil对4株HPV有效,而Cervarix则对2株有效。默克公司计划提高预算,处于三期临床试验的V503疫苗对9株HPV有效。与此同时,席勒正在研发一种“omnivalent”疫苗,这种疫苗产生于不同的毒蛋白,可以提供完整的保护。席勒说:“在组织培养中,这种疫苗可防止我们尝试过的所有HPV病毒的感染。”他预计,这种广谱的抗病毒疫苗可以常规接种男女年轻患者,将大大增加覆盖率(截至2008年,在美国只有18%的13岁到17岁的女孩,获得了HPV疫苗的全疗程的接种)。
科学家们也正在为研制抗幽门螺旋杆菌的疫苗做出不懈的努力,幽门螺旋杆菌大约会导致全球产生60万胃癌患者。2008年,位于德国马格德堡市的奥托-冯·盖里克大学的彼得·马尔弗什那(Peter Malfertheiner)领导的研究团队,展示了这种既安全又对选定的蛋白质具有免疫反应的候选疫苗(现由诺华公司研发)。马尔弗什那说:“这些抗原是幽门螺旋杆菌感染机制的主要参与者,并且我们已经发现了非常重要的系统性反应。”他的团队计划让健康的志愿者同中等毒性的细菌接触,去测试疫苗的防御能力。
朋友还是敌人
大多数癌症(包括像胃癌和结肠癌这样的主要杀手)并不是通过感染引起的。在这种情况下,预防性疫苗必须针对促使肿瘤生长的必需蛋白。幸运的是,在过去的十年当中,对于编码肿瘤蛋白和模拟人类癌症发生的转基因小鼠模型的开发已经取得了巨大成功。意大利博洛尼亚大学的分子肿瘤学家皮尔·路易吉·罗里尼(Pier-Luigi Lollini)指出,早期希望通过为小鼠接种来抵抗HER2/neu蛋白在乳腺癌细胞中的泛滥。罗里尼说:“我们可以避免小鼠成长过程中肿瘤的发生,并且阻止通过HER2基因起反应而引起的致癌过程。他纯粹以动物试验为重点,但是他的同事圭多·福尼(Guido Forni)和费德里卡·卡瓦罗(Federica Cavallo)正在进行能够尽快投入临床试验的人类HER2/neu疫苗计划。
从一定程度上讲,大多数致癌蛋白产生于健康细胞,并且享有“自我”地位的特权,来保护自己不受自身免疫系统的攻击。经过精心挑选可以调高免疫反应的分子佐剂,疫苗可以打破这些固有的耐药性,通过免疫系统来抵抗这些自我蛋白(在自身免疫疾病中不会起坏作用)。例如,托赫和同事们2010年的研究显示,将α-血清蛋白植于患有乳腺癌小鼠中,取得了一定的成果。这种蛋白通常在妊娠后期和哺乳期出现,但托赫也指出,在新形成的肿瘤中也有此种蛋白出现。他说:“我们所做的事情之一就是生成像α-血清蛋白一样的不相容蛋白。”事实上,假如在肿瘤发生前接种,被免疫的小鼠将获得100%的可抵御乳腺癌的保护。动物对乳腺组织的护理使组织破坏和炎症发生受到了限制。对人类来说这应该不是问题,因为高风险的乳腺癌患者一般已过了育龄。托赫说:“大约97%的女性在40岁以后就会停止乳汁分泌,而95%的乳腺癌是发生在这个年龄段。”
许多研究人员主张,针对不同的肿瘤研制成不同的疫苗,从而达到全面保护。华盛顿大学西雅图分校肿瘤疫苗团队的负责人玛丽·迪丝(Mary Disis)说:“你可能会采取多抗原的方法,这些方法甚至会覆盖90%甚至100%不同类型的肿瘤。”匹兹堡大学免疫学家奥利维拉·芬恩(Olivera Finn)的团队曾经将粘蛋白-1(MUC1)作为候选者,芬恩说:“大约80%的癌症患者都特异性地表达了这种蛋白。免疫系统将会发现这种异常表达并产生回应。”但这种自身反应太弱,以致难以防止癌症的发生,但是芬恩和他的同事已研发出一种MUC1疫苗,这种疫苗可以在肿瘤形成前使免疫系统做好准备。早期的试验已证明,一种强大而且具有潜在保护性的免疫反应存在于50%以上的患者体内。芬恩的团队正在匹兹堡与处于高危险的直肠癌患者一起进行MUC1的临床试验(一种为数不多的正在进行临床试验的预防癌症的疫苗)。
痛苦与磨难
预防癌症的疫苗试验面临着重重困难,包括需要长期统计确定无癌者的预防情况。席勒的宫颈癌疫苗的研发工作受益于一个事实,即HPV感染引起的病变是癌症发生的一个强有力的预测因素。他说,Gardasil和Cervarix能否防止癌症发生还没有正式得到证实,但是防止98%的和HPV相关的病变,就代表着对防护来说是一个很好的替代指标。
芬恩和其他的研究人员正在利用相似的病理特征去挑选个体,有可能在短期内获取恶性肿瘤特征。以芬恩的MUC1结肠癌预防实验为例,集中研究腺瘤性息肉患者(结肠壁上生长有不寻常的肿块)。芬恩解释说:“这种生长代表了癌前变化阶段,后期将导致结肠癌。”同样,南加州大学的卡斯特研究小组在接种小鼠不久后,发现前列腺处于癌前生长。此法处于治疗和预防之间,这种疫苗可以降低存在性异常,但是无论如何,应该提高免疫系统的能力,以阻挡癌症进展速度。时间的安排看起来是个关键性的因素,它可以将一种失败的治疗性疫苗和一个成功的预防性疫苗区分开。卡斯特说,如果能在癌症发生以及癌病变扩张前,提早注射疫苗,那么你将会有治愈的机会。从小鼠的研究结果来看是充满希望的,排除死于生长了6至12个月之间的小鼠,其余大部分仍然会存活1.5年,他们将死于衰老,并非前列腺癌。
即使有一个有利的开端,人体试验也将是一个漫长且昂贵的过程(许多公司和投资机构是一个主要阻碍)。尤其是以幽门螺旋杆菌为例的感染问题,将主要影响发展中国家。马尔弗什那说:“对于成本效益的比值的计算是关键。发展中国家没有钱去购买疫苗,而发达国家有对待感染的良好治疗方法。”虽然改进配方和低成本的仿制药可能会在不远的将来解决这个问题,但在贫穷落后的国家看来,仅仅购买像Gardasil这样的存在性疫苗,也是一个高代价的提议。
癌症疫苗的泄露也是存在的一个问题。原计划于2011年3月在亚利桑那州立大学召开第一次专业性会议,突然在2月取消。卡斯特说:“被我们形容为超前急转弯。”然而,将于2011年4月在佛罗里达州召开预防癌症的疫苗研讨会,应该可以激发人们的兴趣。对研究人员而言,对早期多抗原的研究结果不言而明。迪丝回忆说:“当我在15年前进入肿瘤研究领域时,我记得我说过,难以看到有预防癌症的疫苗出现,但我可能食言了。”
资料来源 Nature
责任编辑 李 辉