生物学领域中有太多未知需要被探索,RNAi和后转录调控仅仅是个开始。因为涉及到RNA介导的转录调控的复杂性有许多个层次,整个RNA世界远比我们所了解的复杂

2004年10月,在得克萨斯大学西南医学中心工作的实验室技术员罗莎琳·拉姆(Rosalyn Ram),在一次实验后确信自己肯定把什么东西搞错了。据她回忆,当时的实验结果毫无疑问是很“怪异”的。因为实验室负责人――大卫·科里(David Corey)和贝萨妮·雅诺维斯基(Bethany Janowski)夫妇已经证明:含有类似蛋白质骨架的合成DNA分子,即通常所说的肽核酸能阻止基因转录。为此,他们尝试着用小RNA分子来做同样的事情,并希望其不能阻止基因转录。
RNA激活挑战传统观念
结果发现和肽核酸一样,小RNA分子能作用于相同的启动子使得基因表达在转录水平上沉默。当拉姆看到基因沉默时,认为是实验出了差错。实验数据确实不合常理。通常在转录起始位点处,单链肽核酸直接结合在解旋的DNA上,而双链RNA一直被认为仅能把信使RNA(mRNA)作为靶标来阻止翻译――这一过程已得到很好的阐述,即RNA干扰(RNA interference)或RNAi。那么,它们是怎样产生相同效应的呢?
“我们用了几个月的时间,才说服自己相信那个实验结果是真实的。”科里说。他们检测了几个不同的双链RNA――每个双链RNA含有21个核苷酸,如同用于RNAi实验中的标准小干扰RNA(small interfering RNA)。所有这些RNA都与DNA启动子区恰好互补,但与基因的mRNA几乎没有重叠,以保证这些RNA作用于转录而非翻译。2005年9月,科里夫妇证明了导入的RNA能够抑制多达90%的基因转录。有趣的是,这一发现肯定了加州斯克里普斯研究所的凯文·莫里斯(Kevin Morris)的工作,他在1年前发表了人类细胞中存在该现象的第一个证据。
在他们的实验数据中,科里夫妇还注意到可能存在着比拉姆所见到的更令人难以置信的东西。即几个似乎“失活”且不能减少基因表达的RNA可能使转录增强了25%——50%,“这个实验在我们头脑中撒下了基因激活可能存在的种子。”科里说。为了进一步研究这个趋势,研究人员改用了有更低背景活性水平的一个细胞系――人类孕酮受体基因――实验结果非常明显:不能抑制转录的相同的RNA,在基因表达中能使表达量增加10——20倍。激活效应确实存在。
然而,在科里夫妇发表这个发现之前,另一个实验室已早一步发表了与他们的发现本质上相同的结果。加州大学旧金山分校(UCSF)的李龙承(Long-Cheng Li,中国湖北人)和罗伯特·佩雷斯(Robert Place)领导的一个团队发现,以另外三个基因的DNA启动子为靶标的小RNA也能开启基因转录。与科里夫妇一样,李和佩雷斯也曾一直期望是失活而非激活。李说:“我们觉得很奇怪,因为没有观察到由双链RNA引起的基因沉默,相反,我们看到了强烈的基因激活。”
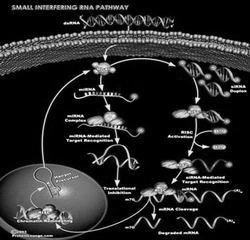
RNA激活技术有望治疗多种疾病
RNA激活(RNA activation)公然违反了所有人对以RNA为基础的调控的理解。人们一直认为只有通过RNA干扰途径切碎mRNA,RNA才能使基因沉默,并不是在基因转录的点上,更不是通过基因激活。因此,RNA领域的许多知名人士根本不相信这一发现。
这两个研究团队在发表他们的论文时都遇到了麻烦。2007年1月,科里夫妇的论文发表在《自然·化学生物学》上(此前,《科学》拒绝发表该论文);李和佩雷斯的论文发表在2006年11月出版的《美国科学院院刊》上(此前曾4次遭到拒稿)。两个月后,当科里夫妇发表了相同的研究结果时,李和佩雷斯认为这对他们是一种解脱。知道其他人也发现了类似的现象,感觉好极了。
是否是个假象倾向实验
然而,这两个研究团队都没能给出RNA激活如何发生的合理机制。加州杜阿尔特市的综合癌症中心的分子遗传学家、论文评审人之一的约翰·罗西(John Rossi)认为,他们的证据并不真正支持所报道的机制。RNA激活违背了我们所知的关于小RNA如何调控基因表达的所有成果。尽管实验数据很清楚,但我们想要更多的实验来确认这个机制,但是他们并未做到。
同样,洛克菲勒大学的RNA专家托马斯·图许尔(Thomas Tuschl)也不相信RNA激活的存在。他在一封电子邮件中写道:“我很难解释他们的发现,并且什么机制又能解释RNA激活这一现象呢?”包括凯斯西储保留地大学的RNAi研究专家蒂莫西·尼尔森(Timothy Nilsen)也认为:RNA激活似乎太不同寻常了,它不像RNA干扰那样是一个普遍的现象。对于RNA干扰,你已知道它是如何起作用的。
学术界普遍采取了一种怀疑和观望的态度。怀疑者甚至认为,把核酸导入细胞是一个有假象倾向的实验,观察到的结果可以很容易归咎于导入的RNA与非靶标分子的相互作用。譬如,一些意想不到的反过来能导致激活的蛋白质或RNA。图许尔说:“每当像这样的有争议的研究结果出现时,我不会触及此类问题,而是等待提出这个问题的实验室的后续研究。”
尽管RNA激活受到广泛怀疑,科里等人仍在致力于探索RNA激活的发生机制,同时为发表他们关于RNA激活的研究成果而努力。曾在2006年9月发表在《自然·结构和分子生物学》上的论文中,科里团队及由莫里斯和罗西领导的团队先后指出,由小RNA介导的转录沉默可能与来自Argonaute家族的蛋白质有关。两个月后,李和佩雷斯也同样证明,Argonaute蛋白参与了RNA激活。虽然对Argonaute家族中哪些蛋白质是最重要的存有一些异议,但研究者们仍然达成了某些共识。
RNA激活现象确实存在
Argonaute蛋白是RNAi途径的已知的成员,它有助于促进RNA与RNA之间的相互作用。因此,新发现的转录调控和Argonaute蛋白之间的联系表明,RNA激活的目标是天然存在的RNA,而不是DNA,这与肽核酸的情况相同。后来,莫里斯直接检测了这个想法,并确认RNA之间确实在相互作用。但是,仍存在一个问题:如果导入的RNA只与其他的RNA相互作用,那么它们是怎样影响转录的呢?
当科学家们探索RNA激活机制时,有一点逐渐变得明白,即人类基因组中的绝大多数基因都被转录成RNA,尽管这些RNA中只有很少一部分被翻译成蛋白质;而一些非编码的RNA转录物(不能产生蛋白质)甚至位于编码蛋白质的基因组区域中。况且这种非编码的转录很多都发生在染色体的两条链上,它们与mRNA的转录方向相同或相反(相反也称为“反义”)。科学家推测,这些普遍存在的非编码RNA可能有某种目的,甚至在RNA激活中起一定作用。
为了找到非编码RNA,科里的学生雅各布·施瓦兹(Jacob Schwartz)对孕酮受体基因启动子进行了扫描,在转录方向上他没有发现有任何编码的RNA,然而却发现了3个跨越启动子区的反义转录物。施瓦兹起初并不相信这一发现,认为这些是基因组DNA的污染物。因为其所学的课业使他相信,在启动子区不会有任何RNA转录物。最后,施瓦兹证明,激活RNA和Argonaute蛋白结合在启动子附近的反义转录物上,然后这个RNA-蛋白质复合体充当一个支架,以“招募”和重新导向其他的蛋白质修饰因子,以加速或减慢转录。
“你必须认为这些启动子是动态的;而基因则处于被开启和关闭的微妙状态中。”科里解释说。在他看来,反义转录物是这一微妙平衡的调控物。通过导入与这些反义转录物作用的RNA,他的团队已能控制朝向激活或沉默的平衡。“我可能是错的,但这是与我们的实验结果一致的最简单的解释。”
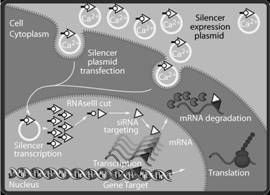
图为在培养环境下的哺乳动物细胞中,经由siRNA传导的RNA干扰机制
比科里夫妇早一年证明小RNA能抑制转录的莫里斯对此有另外一种解释。在重新分析了李和佩雷斯最初使用的激活RNA后得出结论,他认为,激活RNA不以DNA启动子为目标(这一结论UCSF的研究人员曾做出过假设,但从没用实验证明),恰恰相反,这些激活RNA与跨越启动子的长反义RNA转录物部分匹配。尽管莫里斯发现目标序列实际上位于转录起始位点下游的几百对碱基处,比科里夫妇定位的位点更靠下。
在莫里斯的模型中,RNA激活现象与传统的RNAi有相似之处,只是作用目标由mRNA转录物换成了反义RNA。他相信,转录沉默是以不同方式进行的。关闭一个基因需要引入RNA(双链的,或仅是单条反义链),使其作用于跨越启动子区、能被转录但最终不被翻译的mRNA转录物的稀有延伸区。改变mRNA的延伸区就能改变DNA的构型,进而阻止RNA聚合酶进行正常的基因转录。
激活和沉默的正反两面
位于马萨诸塞州剑桥的怀特黑德研究所的RNA生物学家大卫·巴特尔(David Bartel)认为,人类基因组中已被识别的miRNA(microRNA的缩写)有400多个,每一个miRNA都能调控几百个不同的基因。正如大多数的非编码RNA一样,这些小的细胞监督者一直仅被认为通过干扰mRNA和减少蛋白质产生来抑制基因的功能。但是,最近的研究表明,miRNA有多种功能。
去年,李和佩雷斯通过扫描基因启动子区域寻找天然miRNA的目标位点,对RNA激活进行了进一步研究。他们发现,一个与miRNA-373匹配的位点,并证明这个内源性RNA能以与合成RNA相同的方式显著地上调转录。“人们一直认为miRNA只能抑制基因活性,”佩雷斯说,这个研究“从原理上证明了miRNA能有相反的效应,它能导致基因激活。”
其他的研究也发现了相同的效应。譬如,威斯康星大学麦迪逊分校的神经科学家拉格休·维穆甘蒂(Raghu Vemuganti)对老鼠大脑中的miRNA进行了研究,发现有几个miRNA似乎能激活转录。他说:“从生物信息学方面,我可以自信地说大脑中正发生着转录激活;但从实验方面,我们仍需要证明它。”
更重要的是,内源miRNA也能在mRNA生成后的后转录水平上刺激基因表达。耶鲁大学的分子生物学家琼·施泰茨(Joan Steitz)等人发现,miRNA能依赖把细胞作为一个整体的活性来开启和关闭蛋白质的合成:在增殖细胞或连续分裂细胞中,miRNA抑制蛋白质翻译;在静止细胞中,miRNA能激活蛋白质翻译。
miRNA在翻译、激活和抑制中含有相同的基本沉默成分(包括Argonaute蛋白和RNA结合蛋白),再次表明了基因激活和基因沉默可能就如同一枚硬币的正反两面。尽管它们的结合可能不同,但在激活和抑制中,基本的Argonaute蛋白和基本的miRNA是一样的。miRNA似乎还有许多其他功能,但其机制仍是个未解之谜。”
双链RNA激活的蛋白激酶
通过把感兴趣的启动子和绿色荧光蛋白基因结合在一起,李和佩雷斯创建了一个视觉跟踪系统,这一系统可使他们量化转录水平和精确定位RNA激活的目标位点。研究表明,他们的激活RNA导向自身启动子区与科里夫妇的提议相似,而与莫里斯所说的位于下游不同。佩雷斯说:“我们的激活RNA没有靶向反义转录物仍得到激活,这一点与科里和莫里斯的模型相反。”
“整个RNA世界远比我们了解的复杂”
虽然关于RNA激活的几个工作模型还在摇摆不定,但是RNA领域的一些研究人员已对RNA激活产生了兴趣。澳大利亚昆士兰大学的RNA基因组学家约翰·马蒂克(John Mattick)说:“表面上看,现在正发生一个非常有趣的现象。尽管人们可能会挑剔RNA激活的机制,但RNA激活现象确实存在,这一点已十分清楚。”西北大学的RNA研究者埃里克·索泰默尔(Erik Sontheimer)则说:“从小RNA实际正在做的事情看,RNA激活并不是根本上的新现象,它仍属于RNAi的范畴。”
去年12月,《科学》发表的一篇论文表明,基因组中90%以上的基因都被转录,其活性基因的启动子实际上并不“安静”。这就意味着,有许多RNA在细胞中自由行动,可能存在着许多不同的秘密调控效应。对此,莫里斯认为,如果认为RNA激活只有一条途径,那就太目光短浅了。几乎所有的研究人员都同意这一点。科里说,即使还没有一致的解释,RNA激活这一现象的确存在。
当前,研究人员正在积极探索转录激活在医学上的应用。譬如,在含有移植了人类前列腺癌细胞的老鼠模型中,李和佩雷斯设计了能上调肿瘤抑制基因的RNA;莫里斯则在不断提高HIV的表达,希望找到艾滋病病毒的藏身之处;而科里夫妇在利用RNA进行细胞培养中激活了一个重要的“新陈代谢基因”。另外,佩雷斯和莫里斯分别激活了几个与多能性有关的基因,如Oct4和Nanog,并着眼于把成体细胞“重新编程”为类似胚胎干细胞的状态。
商业化的运作同时也在进行。莫里斯目前正在与斯克里普斯研究所合作,以期扩大其研究的市场影响度;科里和佩雷斯则授权奥尼兰姆制药公司使用他们的技术。该公司首席执行官约翰·马拉加诺(John Maraganore)认为,对公司来说,从事RNA激活研究是一个非常合理的延伸。“RNA激活代表了一个全新的平台,尽管还需要向结果的可靠性方向发展,但是已有很多我们能够激活的目的基因。”
并非每个人都相信RNA激活的存在。位于纽约长岛的冷泉港实验室功能基因组学负责人托马斯·金格拉斯(Thomas Gingeras)说:“如果莫里斯和科里报告的是一个真实的现象,那么,人们将能看到此现象并致力于研究它。很显然,在他们完成的实验模型中或是丢失了一些什么,或存在着一些错误。人们将会等待,直到提出一个合理的机制或发现一些缺失的要素。”
科里已经受够了那些除非他能清楚地解释RNA激活机制的每一个细节才会相信其发现的反对者。他说:“我对这些人没有耐心了。如果他们不能提供另外一种解释,他们就必须亲自去做实验。”莫里斯欢迎竞争,因为生物学领域中有太多未知需要探索,RNAi和后转录调控“仅仅是个开始”,他说,“涉及到(RNA介导的转录调控)的复杂性有许多个层次,整个RNA世界远比我们所了解的复杂。”
资料来源 The Scientist
责任编辑 则 鸣



