使生物体运转的催化剂在许多工业过程中是有用的,用改善的合成类似物来代替酶的前景如何呢?
酶使生命成为可能。它们高速度高选择性地催化构成生命的化学变化。酶作为催化剂,使这些化学反应加速而本身并不发生永久性的化学变化。化学家们正在研究能模仿酶的这种行为的简单分子的反应。这些反应不仅将有助于他们更好地理解酶是怎样起作用的,而且将产生一代新的工业催化剂。
天然的酶主要由蛋白质(氨基酸构成的大分子)组成。另外,酶还可含有金属离子及辅酶(催化作用必须的有机小分子)。酶通常在水溶液中起作用,但有些酶在水中并不溶解,而另一些酶在构成生成膜的脂肪物中溶解。虽然酶催化过程的细节各不相同,但对该过程有一大体的描述。欲进行化学反应的分子或分子的基团(底物),结合在酶的裂缝或空穴中,这些裂缝或空穴称为酶的“活性部位”。酶关闭裂缝或空穴,“嵌合”该底物。在活性部位有原子组成的催化基团,接着催化基团与底物作用加速化学反应。这些催化基团可以是构成酶的氨基酸的侧链,例如谷氨酸这种氨基酸在其侧链上就有一酸性基团,它可起催化基团的作用;赖氨酸侧链上有一碱性基团。如果,金属离子结合在蛋白质上,它可作为催化基团。如果结合有辅酶,它通常也在催化过程中起作用。许多酶催化反应包括2个或3个催化基团的协同作用。
催化过程的一个关键问题是底物如何与酶结合。这种结合作用包括静电力(正电荷吸引负电荷)、通过酶的金属原子产生的化学键结合作用或诸如氢键的弱相互作用。在许多情形下,主要作用力是疏水结合作用,底物与酶的油性部分聚集在一起以避免与水溶液的接触。类似的作用力可以把辅酶结合在酶上。在有些情形下,这种结合力是如此之强以至于使得底物发生扭曲或弯曲变形作用,这样的变形作用对于加速反应是有益的。
另一个重要因素是催化基因和底物间的距离有多近。当底物结合在酶上时,起催化作用的化学基团就已与底物接近。接着它们便与底物作用而没有较多的自由度损失,因为它们已经限制于适当的区域。
酶催化的效果是非常惊人的。一个有效的酶能使反应加速1010倍,假使没有这样的加速作用,一个仅需5秒的过程,像读这一句子所需的时间,将需要1500年。在那样长的时间里,将发生其它不需要的化学反应,因而生命将不仅舞变慢,而是不可能。酶催化的关键问题是选择性。特定的酶加速所要求的反应,并不加速不需要的反应。
酶具有4种不同方式的选择性,它们结合特定的化合物,因而它们对底物具有选择性。绝不结合其它分子,或以其它方式结合使得催化基团不能与底物接触。酶的选择性也以对反应选择的方式表现,它催化某一特殊的反应优先于底物可发生的其它化学变化进行。酶加速底物的某一反应成为主要反应否则将是一次要反应的现象并不少见。酶促的反应也具有“区域选择性”,即它只进攻底物的某一部位。例如,一个酶可以结合一个蛋白质分子,但只打断它的许多键中的一个,这是因为酶与底物的结合使得该键处于酶的催化基团能伸及到的范围内。第4种是酶的“立体选择性” 。反应产物有时会以右手和左手似的两种形体存在,这样它们的结构互为镜像,或称光学异构体。大部分简单的化学反应产生光学异构体的混合物,然而,酶的催化基团通常仅能伸,到与酶结合的底物的某一侧面,致使只产生一种异构体。
在过去的20年中,化学家对于建造能复制酶的某些特性的简单化学分子愈来愈感兴趣。进行这一研究的依据有二。首先,化学模型可以帮助我们理解酶是知何起作用的,以及为什么它们是如此有效的催化剂。事实上,生物体内许多酶催化反应的详细了解便是这一研究的结果。它们可以表明某一特殊催化效应会是多么重要。理由之二必须与化学本身的特殊性相联系,化学是一门与其它学科都极不相同的科学。
化学只是“自然”科学的部分,大部分已知的化学物质在自然界并不存在。90%以上的化学物质是由化学家创造的。他们选取天然化合物并分析它们的化学特性,然后利用这些信息创造有用的新物质,比如聚合物和药物、化学科学研究物质及其性质,但也研究化学变化。用以制造新物质的化学反应也大部分是自然界没有的。鉴于人类向自然界学习的欲望,拓宽酶催化概念的计划已经吸引了我们。
模仿酶所做的工作
有许多化学催化剂能高速地有选择地催化奇异的化学变化。然而,在许多方面酶仍然保持着记录。它们不仅高速地有选择地催化多种多样的生物反应,而且是在温和的化学条件和环境温度下进行催化。我们希望知道如何在实验室达到类似的结果,正确的方法是先研究天然酶是如何起作用的,然后应用我们学到的知识来设计人工酶。因而合成酶模型和模仿它们的行为的第二个主要原因是学习如何用生物化学的精巧和有效来做合成化学。
这两个目的是互相补充的。目的之一是利用合成化学作为工具来帮助我们理解生物化学。而目的之二是用生物化学作为工具帮助我们改善合成化学。任一领域的进步都会影响另一领域。一方面,有效的酶模型引导我们去接近有效的人工酶;另一方面,有效的人工酶常常给我们以理解酶本身的化学知识。
—个人工酶应该能结合一个或多个底物,并且有处于适当位置的多个催化基因以催化反应。化学家们已经用几种方法向这一目的接近。
研究者们用连接不同催化基团的方法修饰了一些酶。所形成的半合成酶进行完全不同的反应。例如,由水参与使底物分裂成两个碎片的反应中所涉及到的一个酶,可被修饰成能催化氧化反应的酶。虽然修饰痗仍然是蛋白质,仍然具有蛋白质的化学不稳定性,但仍不失为一种有前途的方法。
然而,如果我们想模仿酶的功能,就需要了解酶如何起作用的。当分子发生反应形成新分子时,它们需通过一“过渡态”,此时它们的键断裂,同时或稍后形成新键。这一过渡态的能量比反应物分子或反应最后生成分子的能量都高。过渡态能量愈高,反应越慢。
催化剂通过与过渡态结合而降低它的能量。当催化剂和化学反应的过渡态相结合时,它便无意识地加速了反应。实际上,设计人工酶的另一途径是蛋白质的修饰,该蛋白质与我们所感兴趣的反应之过渡态相结合。抗原是与抗体结合的蛋白质,它是引入体内的异己分子,并使抗体失去活性。这种结合可以是非常牢固的。化学家们能够制备一些抗体,它们与几个反应的过渡态结合。不出所料,这些抗体结果是这些反应的催化剂,他们并没有连接在酶的活性部位的特殊催化基因。但是,对于某些化学反应,简单的结合就能产生适当的催化作用。另一方面,这些新的催化剂是蛋白质,所以他们的性质和稳定性与天然酶相似。
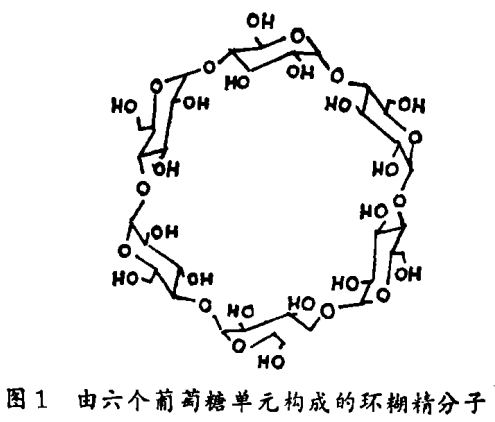
已经证明底物和蛋白质的疏水结合是非常有益的,在这种情况下,底物中厌水的碳氢(烃)部分被吸入蛋白质疏水而类脂的空穴内。许多化学家已经利用合成的疏水空穴为人工酶提供了结合部分。环糊精和它们的衍生物在这一领域起到了支配作用,这些化合物属于由淀粉而来的汽车轮胎状分子的家族,它们是可得到的商品,因而可以用它们来发展对于工业有用的人工酶。虽然环糊精溶于水,“汽车轮胎”的内部却是疏水的(见图1)。在水溶液中,像烃类等疏水的底物趋向于结合在空穴内。在哥伦比亚大学和其它地方,我们已经利用这种性质来构筑能模拟酶而催化商业上重要反应的分子。
一个简单的例子是用环糊精催化Diels-Alder反应。德国化学家奥托 · 第尔斯(Otto Diels)和库特 · 阿尔德(Kurt Alder)发现了这一重要而通用的反应,因此他们获得了1950年的诺贝尔化学奖。药物工业利用Diels-Alder反应来合成药物化合物。它提供了一个合成含碳原子环分子的简单方法。在该反应中,一个含有两个双键,另一个含有一个双键的两个分子通过两个新的键结合在一起形成一环状分子。与许多有机反应不同,Diels-Alder反应并不容易被酸或碱所加速,但使参与反应的两个分子彼此接近能加速反应。
具有适当形状的环糊精分子可以结合两个发生Diels-Alder反应的分子进入周广空穴,使得他们能发生反应 · 我们发现有适当大小空穴的环糊精加速环戊二烯和丙烯腈间的Diels-Alder反应,然而,环糊精分子的大小是问题的关键。较小的环糊精分子不能加速这一反应,它与一种组分结合使该组分不能与另一组分接近,这样反应受到抑制。同样地,有较大分子参与的Diels-Alder反应也受到抑制,这是因为反应物不能进入空穴。这样,这个简单模型显示了与酶相同的底物选择性。
Diels-Alder反应是工业上重要的反应,但没有天然酶能催化它。人工酶是唯一的选择。对于酶催化反应,环糊精是从我们所列出的全郞方式中挑选出的。因此,在这种情况下环糊精可能是实用的人工酶。
对于化学家的最大挑战之一是加速反应达到天然酶所具有的水平。几年前我们所做的一些工作表明这样的加速作用目前是可达到的。我们看一下这样的反应:底物结合进入环糊精的空穴,接着与环糊精本身反应。这与底物首先和酶反应的许多酶催化过程是类似的。然后底物和酶之间的键断裂再生出催化剂,环糊精催化这样的反应仅仅加速100倍。但是,通过重新设计使底物更适当地结合,我们可以设法使反应加速6百万倍。这个系统也具有底物选择性和立体选择性。反应速度的极大加速应归因于底物的反应部位和环糊精的反应基团的接近。现在,我们正在尝试使催化反应达到这_或更大的加速,以使它们有可能应用于科学、工业和医药方面。
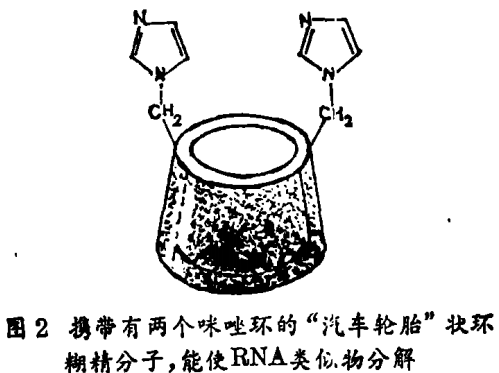
酶具有结合和催化基团这样两部分。人工酶也必须有这两部分的结合,咪唑是一种氨基酸——组氨酸侧链的一部分。在许多酶中它起关键的催化作用。携带有两个咪唑基团的环糊精的性质将是特别引人注目的(见图2)。
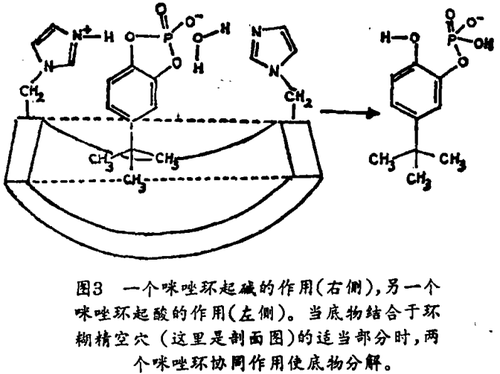
核糖核酸酶是这样的酶,它可以分解它的底物RNA,底物结合进入酶的裂缝中,因而它便与两个咪唑基团接近;在打碎RNA时,它们协同作用。我们连接两个咪唑环于环糊精上,发现它在很多方面模仿了核糖核酸酶。修饰的环糊精加速了与RNA类似但并不相同的底物的分解过程。它显示了一种酶的区域选择特性,也按照与酶相同的化学途径完成了反应。图3给出了人工酶和底物的结构。在催化反应中,RNA类似物结合进入环糊精的空穴,使它的磷酸酿基团处在两个咪唑基团之间。然后,在向底物的磷酸酯基传递水分子的过程中,两个咪唑基团协同作用使底物分解开来。最后,产物被释放,另一底物结合进入空穴并开始再一次循环。许多酶也利用辅酶。允其是在氨基酸的酶催化合成中利用了由维生素B6衍生来的辅酶 · 我们已经合成了有关的人工酶。在最引人注目的例子中,环糊精携带有辅酶和其它的催化基团。该环糊精对底物和反应具有选择性。它也表现出显著的立体选择性。利用具有内在的几何控制力的两种不同催化剂,我们可合成右手性的或左手性的氨基酸。我们也合成了具有不同疏水空腔的有关催化剂,但并非环糊精。另外一些研究者注意到了金属结合作用,而另一些研究者利用氢键来使底物与潜在的催化剂结合。
进行这一研究的动机是为了使化学催化达到在生物化学中我们所认为的有效催化的水平。如果我们能做到这一点,它将产生巨大的实践潜力。模拟酶的新药物将为我们提供与由于酶缺乏或其它机能失调所产生的疾病斗争的另外途径。在制造业方面,用强健的合成酶来代替脆弱的天然酶是很有吸引力的。对于像Diels-Alder反应这样没有合适天然酶能催化的反应,人工酶的发展更具吸引力 · 我们总是希望在室温下进行反应,这样可节省能量,也总是希望反应有这样的选择性,使产物的收率尽可能是而没有不想要的副产物。这样的反应将比目前许多制造化学物质的方法更具诱惑力。
[New Scientist,年7月14日]
_____________________
* Ronald Breslow是纽约哥伦比亚大学获有S. L. Mitchill化学教授荣誉职位的化学家。