生物学中的一个未解之谜,即由各种特化细胞合作构建的人体,却都具有一个相同的基因组。在人体――脑、肝脏、骨骼、心脏和其他器官――内,大约有200种不同类型的细胞,它们一定以某种方式分别读取了写进DNA中的不同的遗传指令

细胞的秘密
人体系统类似一部戏剧,在剧中扮演不同角色的演员都有相同的剧本,但被阻止看其他演员的台词。自然地,受精卵拥有戏剧中的第一份剧本。随着它反复地将剧本拷贝分发到人体10万亿个细胞的同时,也给这些细胞定位了其在人的一生中将扮演的角色。
这个分配过程是如何进行的?研究人员发现,包装基因组DNA的特殊蛋白质中嵌入了第二层次信息。这个第二层次,即通常所说的控制基因访问的表观基因组(epigenome),它允许细胞激活其特殊基因,但封闭了剩下的大部分基因(一个人有一个基因组,但有多个表观基因组)。表观基因组不仅参与界定细胞中哪些基因是需要的,而且控制这些所需基因何时被激活。
在2003年解码了人类基因组之后,表观基因组就成为了生物学中的一个主要研究前沿。
由于表观基因组控制着某些基因的开启或关闭,其任何紊乱行为都很有可能对细胞产生严重的影响。
有许多证据表明,表观基因组的改变有助于对癌症和其他疾病的治疗(表观基因组随年龄增长而改变),如同卵双胞胎通常随着年龄的增长,其外表和行为就会发生一些变化。了解表观基因组的这些变化,有助于阐明或延缓一些老化的症状,抑或是实现再生医学梦想的关键,即从患者自身细胞中获得有效的替代组织。
由于表观基因组是通向了解细胞调控等诸多方面的必经之路,一些研究人员对表观基因组“零打碎敲”的研究方式提出了批评,并呼吁建立一个类似于破译人类基因组项目的大表观基因组计划。目前,美国国立卫生研究院(NIH)有一个表观基因组路线图(Epigenome Roadmap)项目,投入资金为1.9亿美元,由为数不多的几个机构在研究。
地处剑桥市的怀特黑德基因组研究中心的生物学家理查德·杨(Richard A.Young)说:“类似人类基因组计划,我相信,表观基因组带给人类的好处将超出我们的预测。

千百年来,人们一直在探索人类多样性的根源所在
表观基因组
表观基因组包含着几千万个化学修饰物,或称为标记。这些标记是根据染色质的长度和染色体的材料“做”出来的。染色质包括双链DNA和缠绕它的蛋白质;而构成表观基因组的一些标记直接被“做”在DNA上,但是大部分标记集中在从蛋白质缠绕中伸出的DNA的短尾上。某一种类的标记一般会贯穿于包含一个或多个基因的DNA的大部分或整个区域;而染色质调节蛋白能识别这些标记,并执行标记指示的任务。
在一些标记域内,DNA被这些调节蛋白紧密盘绕,以致基因永远不能表达(染色体的中心和两端是这些区域的所在处)。如女性的细胞中有两个X染色体,其中一个被紧密盘绕,这就确保女性和男性细胞中基于X染色体的基因具有相同水平的活性。
在其他域,这些标记是自由的,它们允许被称为转录因子的基因调控子在DNA上找到自己的位点;然后开始“招募”这个复杂的转录机制的其他成员,并启动复制基因和制造细胞所需要的蛋白质。在转录机制形成之前,必须建立一种三级域,以便能让三级域沿着DNA滚动,并转录基因的基本信息。
迄今为止,我们只知道少量的域(已在表观基因组中发现了100多种标记)。在某种意义上说,对这些标记指定具体的域是个难题;而一些生物学家认为,如此众多的标记需要指定几种域,因为这个系统充满了备份。
在基因组的标记中,表观基因组的角色似乎被定位在一个更古老的包装之上。像酵母菌这样的单细胞生物,为了使它的基因组保持在一个特定的区域――细胞核内――就需要对基因组进行包装;对多细胞生物体而言,在进化的过程中为满足不同类型细胞的需要,染色质的包装系统可能是逐渐适应对基因组的“编入索引”。
DNA包装系统是一个非凡的技术壮举。如果人的细胞核类似一个网球般的空心球,那么,基因组的DNA将是一条约24英里长的细线,而且这条线必须装进球中且没有任何损伤。用这样的方法,应该能找到它的任何区域。
细胞的表观遗传
承担包装工作的是一组称为组蛋白(histone)的特殊目的蛋白质――由8个组蛋白连接在一起形成一个称为核小体(nucleosome)的小线轴,DNA围着每个核小体差不多缠绕两圈。一个普通细胞中的DNA,需要包装大约3000万个核小体。
长久以来生物学家一直在设想:核小体中的组蛋白为DNA提供了一个被动的结构框架。但是在过去十年中,人们越来越清楚地认识到事实并非如此――从核小体伸出的组蛋白尾巴提供了一种标记基因的“剧本”方式――虽然一种标记被直接连在DNA的碱基上,但是其他的100多种标记被固定在组蛋白尾巴的特殊位点。
对于细胞分裂,当DNA复制时,这些直接标记仅仅传递给两条母链,同时所有的核小体被拆散。然而,细胞有巧妙的方法在两个子代基因组中重建相同的标记。这些标记被称作是表观遗传,而整个系统被称为表观基因组,尽管它们不是在DNA中被编码的,而是通过细胞分裂继承得到的。
表观基因组的结构是如何被确定的?马萨诸塞州总医院的染色质专家布拉德利·伯恩斯坦(Bradley Bernstein)认为:“表观遗传的大部分表现都是由DNA序列决定的。”因为人类基因组包含有许多调节基因,这些调节基因产生的蛋白质(通常所说的转录因子)控制着其他基因的活性,其中的主调节基因控制着子调节基因――通过主转录因子作用于其他基因建立的这条线路的信息输出,塑造了摆脱受精卵后的表观基因组最初的级联。
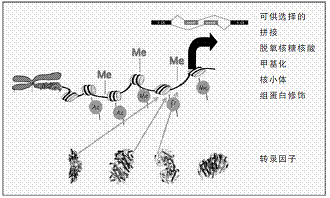
表观基因组学和转录控制示意图
表观基因组的其他塑造者是染色质调节子(chromatin regulator)和阅读组蛋白短尾上标记的蛋白质:这些塑造者或将一种给定的标记贯穿整个域,或将核小体“捆绑”使基因沉默,还有一些塑造者则将DNA与核小体线轴“松绑”,便于转录机制沿着基因滚动的路径前行。
生物学家过去一直在设想,一旦染色质调节子塑造了一个表观基因组,那么它们的工作可能无法被复原,原因是单个细胞的命运基本是不可逆的。然而2007年6月,日本生物学家山中伸弥完成的一个非凡的实验,揭示了主转录因子其令人惊讶的神奇。
通过将4个主调节基因插入皮肤细胞中,山中伸弥证实了由这些基因制造的转录因子,能够对皮肤细胞的表观基因组“重新编程”(回到胚胎细胞的表观基因组),而皮肤细胞正是从胚胎细胞发育得到的。在这个实验中,皮肤细胞的表现就像一个胚胎细胞,而不是一个皮肤细胞。在此之前,生物学家不知道表观基因组能够被如此简单地重塑,也不知道转录因子能够如此明显、果断的发号施令。
但是随后的研究表明,染色质调节子并不容易被征服。在插入了4个转录因子的100万个皮肤细胞中,只有1个皮肤细胞能够完全恢复到胚胎状态,大部分皮肤细胞都处于过渡状态,似乎这些染色质调节子正在抵抗细胞中可能发生的癌变。对此,伯恩斯坦博士说:“转录因子是决定细胞状态的关键因素,其中表观遗传学也是非常重要的。”
构筑芯片-序列图
再生医学的理想是,首先把患者的正常体细胞转回到胚胎状态,然后转变成特定的因疾病丢失的细胞。为了安全和有效地制备这些细胞,研究人员需要学会如何控制和操纵表观基因组的染色质,以及那些决定细胞识别的转录因子。
对于许多疾病的治疗,可能在于那些能操纵表观基因组的药物。如瑞特综合征(一种常发生在女童身上的神经系统疾病,其特征是患者出现类似自闭症行为、运动控制能力丧失、呼吸不规律等――译者注),它是由一种基因突变引起的,这种基因产生的酶能够识别DNA上的染色质标记。至少在老鼠中,当这个突变被校正后,它的神经元也就恢复了正常功能。在其他一些类型的癌症中,肿瘤抑制基因的失活不是我们通常所知的突变,而是因为标记的错误放置,那些标记会“邀请”染色质调节子来使基因沉默。
表观基因组中病变的本质所在
南加州大学的彼得·琼斯(Peter A..Jones)研制的药物,可以逆转这些抗肿瘤基因的染色质沉默。近来,美国食品与药品管理局(FDA)批准了两个新药,用于治疗一种血液恶性肿瘤――骨髓发育不良综合征(myelodysplastic syndrome)。
除了可以调节基因,表观基因组还可以接收来自其他环境的信号。一个被称为“sirtuins”(一种从细菌到人类都高度保守的去乙酰化酶类。人类sirtuins家族中公认的成员有7个――译者注)的酶家族负责监视细胞的营养状况,其中的一个成员能从染色质中除去一个特殊的标记,这为基因组应对可能的“饥荒”状况提供了一条途径。
目前,研究表观基因组标记的主要手段是将染色体片段化,然后用结合到特定标记上的抗体进行处理――对这些标识的DNA片段进行解码,将它们与人类基因组序列上的位点相匹配。这就提供了一个关于特定标记在表观基因组状态下是如何分布的全基因组图谱。尽管这些图被称为芯片-序列图谱(CHiP-seq map)且非常有用,然而还远不能捕捉到表观基因组的全部细节――表观基因组是一个在几分钟内就会改变的动态结构。
尽管个别研究人员在这方面已经取得了很大进展,但是还没有集合成表观基因组标记和状态的全面数据,而这将对治疗疾病和延缓衰老的新疗法极其有用。“我认为,要把各种力量组合起来,”理查德·杨博士说,“我们将从中得到更大的好处。”







